Відділ заснований академіком НАНУ А. І. Кіпріановим у 1945 р. і був очолюваний ним до 1972 р. З 1972 по 1976 рр. відділом керував канд. хім. наук, ст.н.с. В. М. Зубаровський, з 1976 по 2005 рр. — докт. хім. наук, проф. О. І. Толмачов. Нині відділ, у якому працює 12 наукових співробітників (3 доктори наук, 5 кандидатів наук) і 5 інженерів, очолює академік НАН України О. О. Іщенко.
-

Завідувач відділу: д. х. н., професор, академік НАН України Олександр Олександрович Іщенко.
Основний науковий напрямок відділу
Відділ є світовим лідером у області синтезу, дослідження та розробки багатофункціональних світлочутливих матеріалів на основі органічних барвників, перш за все, ІЧ спектрального діапазону [1−11]. Основним об’єктом дослідження є поліметинові барвники [1−6]. Розроблені методи синтезу барвників різної іонності, а саме: іонних — катіонних [1,4], аніонних [1,4,6,12,13] і катіон-аніонних [14,15] поліметинів; внутрішньоіонних — мероціанінів [1,4,16,17], кетоціанінів [18,19], мезоіонних [20], скварилієвих [21−24], кроконієвих [21,24,25] і дифтороборатних цвітер-іонних, у тому числі борадипірометенів (BODIPY) [26−30].
Напрямки досліджень
• Дизайн і синтез функціональних органічних барвників
• Взаємозв’язки структура–властивості в органічних хромофорах/флуорофорах
• Вплив середовища на спектральні властивості іонних та донорно-акцепторних барвників
• Сенсибілізуючі та десенсибілізуючі барвники
• Хромофори, що поглинають і випромінюють світло в ближньому ІЧ діапазоні спектра
• Барвники та доповані барвниками полімерні композити для лазерної генерації, модуляції добротності, синхронізації мод, захисту від високопотужного опромінення
• Голографічні реєструвальні середовища
• Органічна фотовольтаїка
• Флуоресцентні барвники для біомедичних застосувань
• Хемосенсори та мітки
Співробітники відділу
• зав. від., д. х. н., проф.,акад. НАН України Іщенко Олександр Олександрович
• пров. н. с., д. х. н., проф. Ковтун Юрій Петрович
• ст. н. с., д. х. н. Кулініч Андрій Володимирович
• ст. н. с., к. х. н. Дехтяр Марина Львівна
• ст. н. с., к. х. н. Курдюков Володимир Вікторович
• ст. н. с., к. х. н. Курдюкова Ірина Володимирівна
• ст. н. с., к. х. н. Шандура Микола Петрович
• пров. інж., к. х. н. Сломінський Юрій Леонідович
• пров. інж. Варич Євгенія Степанівна
• пров. інж. Дерев’янко Надія Олексіївна
• пров. інж. Смирнова Ганна Леонідівна
• пров. інж. Чепелєва Лариса Василівна
• інж. І кат. Кудінова Маргарита Олександрівна
• інж. І кат. Смірнова Тетяна Василівна
• інж. Микитенко Олена Костянтинівна
• інж. Поліщук Владислав Михайлович
• інж. Шаранов Ілля Павлович
• техн. І кат. Дем’яненко Алла Анатоліївна
Найважливіші публікації відділу за 2018 – 2021 роки
- Ishchenko, A. A.; Kulinich, A. V.; Bondarev, S. L.; Raichenok, T. F. UV–Vis absorption spectra and electronic structure of merocyanines in the gas phase. Spectrochim. Acta A 2018, 190, 332–335. DOI:10.1016/j.saa.2017.09.054
- Didukh, N. O.; Yakubovskyi, V. P.; Zatsikha, Y. V.; Nemykin, V. N.; Kovtun, Y. P. Meso-nitromethyl-substituted BODIPYs – A new type of water switchable fluorogenic dyes useful for further core modifications. Dyes Pigm. 2018, 149, 774–782. DOI:10.1016/j.dyepig.2017.11.037
- Davidenko, N. A.; Davidenko, I. I.; Mokrinskaya, E. V.; Chuprina, N. G.; Ishchenko, A. A.; Shemehen, R. V.; Milokhov, D. S.; Khilya, O. V.; Volovenko, Y. M. Photophysical properties of a composite based on polyepoxypropylpyridobenzothiazole with the squarylium dye. J. Appl. Spectrosc. 2018, 85 (5), 870–874. DOI:10.1007/s10812-018-0731-4
- Polishchuk, V.; Stanko, M.; Kulinich, A.; Shandura, M. D–π–A–π–D dyes with a 1,3,2-dioxaborine cycle in the polymethine chain: Efficient long-wavelength fluorophores. Eur. J. Org. Chem. 2018, 2018 (2), 240–246. DOI:10.1002/ejoc.201701466
- Bricks, J. L.; Slominskii, Y. L.; Panas, I. D.; Demchenko, A. P. Fluorescent J-aggregates of cyanine dyes: Basic research and applications review. Methods Appl. Fluoresc. 2018, 6 (1). DOI:10.1088/2050-6120/aa8d0d
- Kulinich, A. V.; Ishchenko, A. A.; Bondarev, S. L.; Knyukshto, V. N. Low-temperature effect on the electronic structure and spectral-fluorescent properties of highly dipolar merocyanines. J. Phys. Chem. A 2018, 122 (50), 9645–9652. DOI:10.1021/acs.jpca.8b09522
- King, A. J.; Zatsikha, Y. V.; Blessener, T.; Dalbec, F.; Goff, P. C.; Kayser, M.; Blank, D. A.; Kovtun, Y. P.; Nemykin, V. N. Ultrafast electron-transfer in a fully conjugated coumarin-ferrocene donor-acceptor dyads. J. Organomet. Chem. 2019, 887, 86–97. DOI:10.1016/j.jorganchem.2019.03.004
- Ishchenko, A. A.; Mchedlov-Petrossyan, N. O.; Kriklya, N. N.; Kryshtal, A. P.; Ōsawa, E.; Kulinich, A. V. Interaction of polymethine dyes with detonation nanodiamonds. ChemPhysChem 2019, 20 (8), 1028–1035. DOI:10.1002/cphc.201900083
- Kulinich, A. V.; Derevyanko, N. A.; Ishchenko, A. A.; Gusyak, N. B.; Kobasa, I. M.; Romańczyk, P. P.; Kurek, S. S. Structure and redox properties of polymethine dyes: Electrochemical and DFT/TD-DFT study. Dyes Pigm. 2019, 161, 24–33. DOI:10.1016/j.dyepig.2018.09.031s
- Dekhtyar, M.; Rettig, W.; Rothe, A.; Kurdyukov, V.; Tolmachev, A. Variation of donor and acceptor strength in analogues of Brooker’s Merocyanine and generalization to various classes of charge transfer compounds. J. Phys. Chem. A 2019, 123 (13), 2694–2708. DOI:10.1021/acs.jpca.8b10660
- Humeniuk, H. V.; Derevyanko, N. A.; Ishchenko, A. A.; Kulinich, A. V. Merocyanines based on 1,2-diphenyl-3,5-pyrazolidinedione. New J. Chem. 2019, 43 (35), 13954–13966. DOI:10.1039/c9nj03275d
- Kulinich, A. V.; Ishchenko, A. A. Electronic structure of merocyanine dyes derived from 3H-indole and malononitrile in the ground and excited states: DFT/TD-DFT analysis. Comput. Theor. Chem. 2019, 1154, 50–56. DOI:10.1016/j.comptc.2019.03.018
- Davidenko, N. A.; Davidenko, I. I.; Ishchenko, A. A.; Kurdyukova, I. V.; Mokrinskaya, E. V.; Tonkopieva, L. S.; Chuprina, N. G. Photoelectric properties of composite films based on poly(N-epoxypropyl carbazole) and merocyanine dyes. J. Appl. Spectrosc. 2019, 86 (4), 578–583. DOI:10.1007/s10812-019-00862-w
- Dimitriev, O. P.; Piryatinski, Y. P.; Slominskii, Y. L. Abnormal emission in the heterogeneous J-aggregate system. J. Phys. Chem. C 2019, 123 (47), 28611–28619. DOI:10.1021/acs.jpcc.9b08248
- Kurdyukov, V. V.; Vlasenko, Y. G. Isomeric Bisdicyanomethylene-substituted 1,3- and 1,2-pyrilo-4-squaraines: Synthesis, molecular, and crystal structure. Russ. J. Gen. Chem. 2019, 89 (2), 212–218. DOI:10.1134/S1070363219020075
- Kulinich, A. V.; Kurdyukov, V. V.; Ishchenko, A. A. Effect of bulky substituents in the donor and acceptor terminal groups on solvatochromism of Brooker’s merocyanine. New J. Chem. 2019, 43 (19), 7379–7385. DOI:10.1039/c9nj00831d
- Kulinich, A. V.; Ishchenko, A. A. Structures and fluorescence spectra of merocyanine dyes in polymer films. J. Appl. Spectrosc. 2019, 86 (1), 35–42. DOI:10.1007/s10812-019-00777-6
- Kurdyukov, V. V.; Kurdyukova, I. V. Unsymmetrical 2,6-di-tert-butyl-substituted pyrylo-4-squaraines. Russ. J. Org. Chem. 2019, 55 (1), 93–100. DOI:10.1134/S1070428019010111
- Dimitriev, O.; Fedoryak, A.; Slominskii, Y.; Smirnova, A.; Yoshida, T. Phonon-assisted anti-stokes luminescence of tricarbocyanine near-infrared dye. Chem. Phys. Lett. 2020, 738. DOI:10.1016/j.cplett.2019.136905
- Afanasyev, D. A.; Ibrayev, N. K.; Omarova, G. S.; Kulinich, A. V.; Ishchenko, A. A. Spectral-luminescence and lasing properties of merocyanine dye solutions in the presence of silver nanoparticles. Opt. Spectrosc. 2020, 128 (1), 61–65. DOI:10.1134/S0030400X20010026
- Derevyanko, N. A.; Ishchenko, A. A.; Kulinich, A. V. Deeply coloured and highly fluorescent dipolar merocyanines based on tricyanofuran. Phys. Chem. Chem. Phys. 2020, 22 (5), 2748–2762. DOI:10.1039/c9cp05827c
- Kulinich, A. V.; Ishchenko, A. A.; Bondarev, S. L.; Knyukshto, V. N. Effect of donor and acceptor end-groups on electronic structure and spectral-fluorescent properties of merocyanines in frozen ethanol. J. Photochem. Photobiol. A 2021, 405. DOI:10.1016/j.jphotochem.2020.112932
- Polishchuk, V.; Kulinich, A.; Rusanov, E.; Shandura, M. Highly fluorescent dianionic polymethines with a 1,3,2-dioxaborine core. J. Org. Chem. 2021. DOI:10.1021/acs.joc.1c00138
- Zatsikha, Y. V.; Blesener, T. S.; King, A. J.; Healy, A. T.; Goff, P. C.; Didukh, N. O.; Blank, D. A.; Kovtun, Y. P.; Nemykin, V. N. Fully conjugated pyrene-BODIPY and pyrene-BODIPY-ferrocene dyads and triads: Synthesis, characterization, and selective noncovalent interactions with nanocarbon materials. J. Phys. Chem. B 2021, 125 (1), 360–371. DOI:10.1021/acs.jpcb.0c10074
- Shishkina, S. V.; Ishchenko, A. A.; Kulinich, A. V. Structure and intermolecular interactions of the fully negative solvatochromic merocyanine in the crystal phase. Struct. Chem. 2021, 32 (3), 1341–1345. DOI:10.1007/s11224-021-01774-2
Основні наукові та практичні досягнення відділу
З метою стабілізації глибоко забарвлених барвників розроблені синтетичні методи введення в їх хромофор місткових угруповань. Це дозволило, всупереч загальноприйнятій думці про неможливість існування стійких барвників, що інтенсивно поглинають світло в області понад 1200 нм, отримати такі сполуки [4]. Досягнуто найбільш довгохвильове поглинання, обумовлене π–π*переходом, серед відомих органічних сполук (1620 нм) [4].
Виявлено явище девіації в електронних спектрах несиметричних поліметинів і взаємодія хромофорів у бісціанінах [1]. Проведено піонерські роботи в галузі просторової будови, впливу природи замісників та сольватохромії ціанінів [1], перші роботи в області кетоціанінів і поліонів [18,19]. Синтезовані барвники з рекордними електронною асиметрією (девіація максимумів поглинання понад 500 нм) і стоксовим зсувом (Рис. 1) [31]. Отримано перші представники органічних барвників зі спряженими катіонним та аніонним хромофорами (Рис. 2) [32].
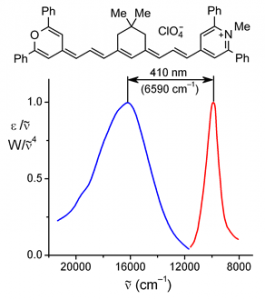
Рис. 1. Спектри поглинання і флуоресценції поліметинових барвників з рекордним Стоксовим зсувом (в ацетонітрилі).
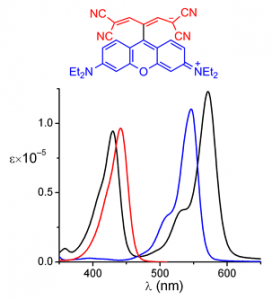
Рис. 2. Спектри поглинання барвника зі спряженими катіонним та аніонним хромофорами (чорна крива) та його складових (у етанолі).
Синтезовані незвичайні поліметини на основі бородипірометену та дифтородіоксаборину [26−30], що мають високі перетини двохфотонного поглинання й квантові виходи флуоресценції в області 700−900 нм [33,34]. Розроблено шляхи синтезу та досліджено властивості поліметинових барвників нового типу, у яких кінцевими групами є не гетероцикли, а карбоцикли [12,13,23,24,35]. Закладено фундамент теорії люмінесценції поліметинів [3,36] та фотоніки їхніх іонних пар [37,38]. Вперше проведено аналіз форми електронних смуг поліметинових барвників [39,40], що дало можливість отримати інформацію про селективність їхнього поглинання, встановити її зв’язок з їхньою будовою і виявити фактори, що його визначають [3,34,40]. Розроблено основні положення теорії міжмолекулярних взаємодій у рідких розчинах і полімерних матрицях ціанінів [41−45]. Встановлено закономірності асоціації барвників, включаючи J-агрегацію [3,46−52].
Сформульовано й підтверджені експериментально критерії керування електронною будовою мероціанінів у всьому діапазоні трьох граничних ідеальних станів [нейтральний полієн – поліметин – диполярний полієн], а також знаком їхньої сольватохромії (позитивна, негативна або обернена) шляхом варіювання донорно-акцепторних властивостей кінцевих груп, довжини поліметинового ланцюга, природи розчинника й температури [16,53−59]. (Рис. 3)
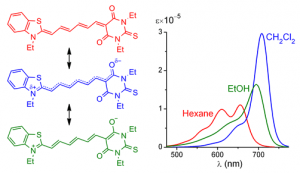
Рис. 3. Спектри поглинання мероціаніну з оберненою сольватохромією, який залежно від полярності середовища може досягати всіх трьох ідеальних станів.
Спільний аналіз великого обсягу експериментальних даних із результатами квантово-хімічних розрахунків молекул сучасними методами дав можливість отримати якісно нові відомості про електронну будову основного й збудженого станів барвників і встановити фундаментальні закономірності, що зв’язують кольоровість і флуоресцентні властивості поліметинів з їхньою будовою і природою середовища, у тому числі в полімерних матрицях. Це дозволило провести цілеспрямований синтез барвників із заданими властивостями для прикладних задач, пов’язаних з перетворенням світлової енергії.
• Барвники для інфрахроматичних фотографічних плівок [60]. Матеріали на їхній основі значно перевищують за роздільною здатністю та чутливістю відомі аналоги, у тому числі Kodak Aerographic Film 3432. Вони дозволяють виявити деталі об’єктів закритих атмосферним серпанком, або тих, які перебувають під шаром покриття (плівка І-1060В) і використовуються для отримання інформації про стан земної поверхні, морського шельфу, оцінки якості посівних площ і лісових масивів, а також при картографуванні (Рис. 4).

Рис. 4. Фрагмент иконостасу XVIII в. (Таллінн): зліва — на нанохроматичній плівці КН-2, справа — на інфрахроматичній плівці І-1060В.
• Нові типи активних лазерних середовищ, що генерують у області 600−900 нм, на основі несиметричних барвників з рекордно широкими смугами поглинання та стоксовими зсувами (Рис. 1) [31,61,62]. Це дає можливість використовувати один і той же барвник для різних доступних джерел накачки (λ = 308, 510, 532, 578, 694 нм).
• Нове полімерне активне лазерне середовище, на якому вперше отримана перебудовувана генерація в лазері на барвниках при накачці 1060 нм [62]. Ефективність перетворення в діапазоні > 1100 нм досягає 43%, що відповідає кращим зразкам видимого діапазону.
• Пасивний затвор, який дозволив уперше в світовій практиці здійснити режим пасивної синхронізації мод у важливому для волоконної оптики, дальнометрії та офтальмології ербієвому лазері (λem = 1540 нм) [63] (Рис. 5).
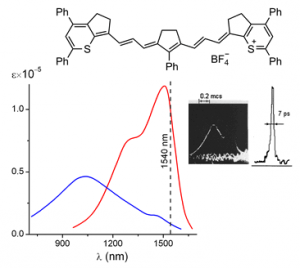
Рис. 5. Пасивна синхронізація мод ербієвого лазера. Показані спектри поглинання барвника в ацетонітрилі (синя лінія) та орто-дихлоробензені (червона лінія).
• Високоефективні полімерні пасивні затвори для нано- й пікосекундних твердотільних лазерів із довжиною хвилі випромінювання 694 [64], 1060 [65–67] і 1300 нм [68] та з високим експлуатаційним ресурсом напрацювання в точку.
• Абсорбційні світлофільтри на основі забарвлених полімерів для захисту від лазерного випромінювання в області 1060 нм [69]. Вони послаблюють випромінювання залежно від завдання на 4−6 порядків при візуальному пропусканні 40−90% і здатні працювати, на відміну від інтерференційних світлофільтрів, при будь-яких кутах падіння лазерного випромінювання.
• Барвники, здатні сильно змінювати дипольний момент при електронному збудженні як у бік збільшення, так і зменшення. Серед них знайдено й досліджено сполуки з яскраво вираженими нелінійно-оптичними властивостями [33,34,70−73].
• Нові голографічні реєструвальні середовища на основі фототермопластичних полімерів і барвників для неруйнівного контролю якості металевих конструкцій [74,75]. На відміну від аналогів, вони не потребують захисту від зовнішнього світла при формуванні прихованого зображення, що дозволяє використовувати їх у польових умовах.
• Фотовольтаїчні композиції, що мають світлочутливість у області максимального сонячного потоку фотонів, для сонячних комірок [76−78].
• Барвники для композицій, що фотополімеризуються під дією напівпровідникових лазерів (λem = 405, 650, 780, 830, 860 і 980 нм). Виявлено невідомий раніше для органічних барвників ефект — ініціювання / інгібування термополімеризації метилметакрилату поліметиновими барвниками у відсутності стандартного ініціатора [79].
• Висококонтрастні флуоресцентні зонди для медицини та біології [80–82] (Рис. 6)
• Тіасквараїни з практично 100% квантовим виходом у триплет, що завдяки цьому є високоефективними сенсибілізаторами утворення синглетного кисню [83].
• Хемосенсори для визначення якості харчових продуктів.
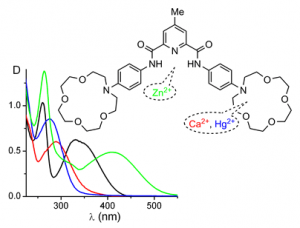
• Нові селективні хемосенсори і мітки на катіони [84] і аніони [85] похідні біс-амідів 2,6-піридиндикарбонової кислоти. На їхній основі створена нова іонофорна рецепторна система, у молекулі якої є кілька координаційних центрів. При комплексоутворенні з солями Co2+, Zn2+ та Ni2+ координування відбувається за піридиновим фрагментом сенсора й супроводжується батохромним зсувом смуги поглинання, а з солями Pb2+ Hg2+, Cd2+,Mg2+ і Ca2+ утворюється азакраун-комплекс і смуга поглинання зсувається гіпсохромно (Рис. 7).
• Синтезовані діоксаборинові барвники — ефективні люмінесцентні індикатори на первинні та вторинні аліфатичні аміни (Рис. 8) з нижньою межею визначення до 1 μМ (1 ppm), що порівнювано з чутливістю індофенольного методу визначення аміаку [86]. Однак останній метод потребує значно більше часу, наявності спеціальних реагентів і не підходить для визначення вторинних амінів. Розроблені індикатори можуть бути застосовані для контролю екологічної ситуації на виробництві подібних амінів.
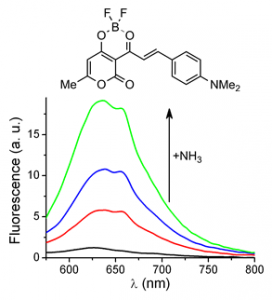
Рис. 8. Зростання інтенсивності флуоресценції діоксаборину при додаванні аміаку до його водно-метанольного розчину
• Вивчено закономірності полієн–поліметинових структурних варіацій мероціанінових барвників у кристалічному стані [87,88]. Встановлено, що для позитивно сольватохромних сполук вони подібні до закономірностей у розчинах, тобто їхня диполярність зменшується із подовженням поліметинового ланцюга. Для негативно сольватохромних мероціанінів спостерігається протилежна тенденція, тобто збільшення диполярності для вищих вінілогів. Показано, що для мероціанінів у кристалі ідеального поліметинового стану можна досягти шляхом раціонального підбору донорно-акцепторних властивостей їхніх кінцевих груп (Рис. 9).
Рис. 9. Схематичне зображення електронної структури (чергування довжин зв’язків) мероціанінів у кристалі (на основі рентгеноструктурних даних).
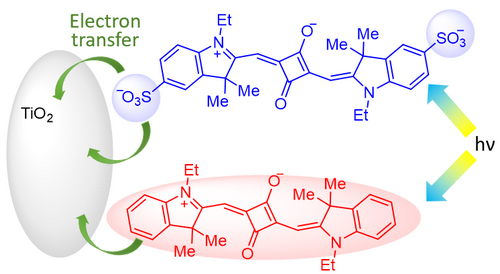
• Для посилення сорбції скваратів на наночастинках TiO2 синтезовано водорозчинні скварилієві барвники із анкерними сульфо-групами [89]. Це привело до поліпшення фотоелектричних характеристик сонячних елементів Гретцеля на їхній основі.
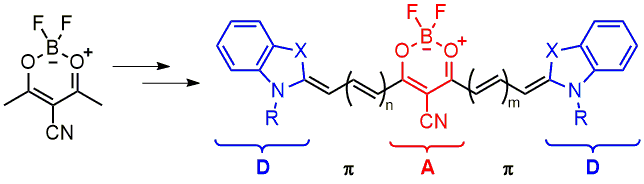
• Синтезовано нові поліметинові барвники з 1,3,2-діоксабориновим циклом як центральною частиною поліметинового ланцюга: нейтральні D-π-A-π-D та діаніонні A1-π-A-π-A1 [90, 91]. Отримані сполуки є інтенсивними флуорофорами для червоної та ближньої ІЧ області спектру.
• Вперше досліджено спектри поглинання мероціанінів у газовій фазі [92]. Встановлено, що в парах їхня електронна структура значно менш диполярна, ніж навіть у неполярному н-гексані, що виявляється як у гіпсохромному зсуві довгохвильової смуги поглинання, так і в її розширенні, симетризації, зменшенні вініленового зсуву. Співставлення результатів TD-DFT розрахунків з експериментальними даними показало їхню кращу кореляцію для газової фази, ніж для розчинів. Отже, спектральні дані в парах є корисними для оцінки різних квантово-хімічних підходів [92,93].
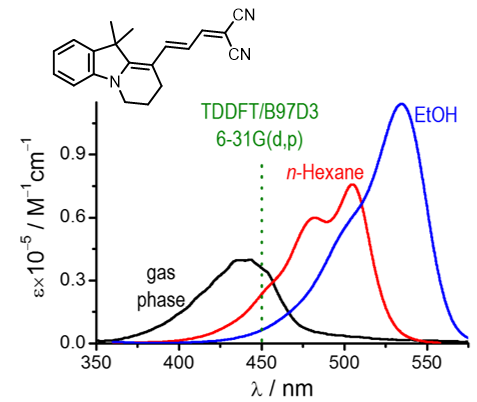
• Термохромію закономірних рядів мероціанінів досліджено в етанолі за температур від 293 до 77 К [53,94,95]. За спектральними даними виявлено, що за низької температури електронна будова більш диполярних барвників стає сильно цвіттер-іонною як в основному, так і в флуоресцентному станах. У крайніх випадках це приводить до незвичайних ефектів: зменшення квантових виходів флуоресценції та збільшення стоксового зсуву в замороженій матриці [95].
• Вперше синтезовано стилбазолієві мероціаніни з 2,6-ди-трет-бутил заміщеним донорним залишком піридину [96]. Їхні спектри поглинання та флуоресценції в наборі розчинників різної полярності порівняно зі спектрами мероціаніну Брукера та його похідного з об’ємними замісниками в акцепторній кінцевій групі. Це дозволило розрізнити вплив нуклеофільної та електрофільної сольватації на їхню сольватохромію, виявивши, що перша, хоч і має менший вплив у цьому випадку, є істотним чинником у таких розчинниках як піридин і ДМФА.

• Синтезовано й досліджено ряди мероціанінів із залишком 1,2-дифеніл-3,5-піразолідиндіону. Виявлено, що його акцепторна сила — усупереч літературним даним — менша за акцепторну силу тіобарбітурової кінцевої групи [97]. Слабку флуоресценція деяких із досліджених барвників пояснено, на основі розрахунків TD-DFT і CC2, швидкою конкурентною безвипромінювальною дезактивацією збудженого стану, пов’язаною з нетиповим низько розташованим нефлуоресцентним ππ*-збудженим станом.
• Уперше виконано систематичне дослідження електрохімічних властивостей катіонних, аніонних та мероціанінових поліметинів методом циклічної вольтамперометрії, що дало змогу проаналізувати вплив структурних параметрів, а саме: заряду хромофора, донорно-акцепторних властивостей кінцевих груп, довжини поліметинового ланцюга та молекулярної симетрії — на окисно-відновні потенціали таких барвників [98]. Статистичний аналіз отриманих даних та результатів розрахунків методом DFT дозволив запропонувати лінійні кореляційні рівняння, які можна використовувати для надійного прогнозування енергій граничних молекулярних орбіталей (HOMO та LUMO) при пошуку й дизайні молекул із необхідними електрохімічними властивостями.
• Розроблено ідеологію та стратегію створення мероціанінів для практично важливого ближнього ІЧ діапазону спектра з більшою інтенсивністю поглинання та флуоресценції, ніж відповідні іонні поліметини [99]. Шляхом підбору характеристик кінцевих груп цього ефекту можна досягти як у сильно-, так і в малополярних середовищах, у тому числі в полімерних матрицях. Розроблені мероціаніни мають переваги перед іонними барвниками при використанні в сонячних елементах і голографічних середовищах, оскільки завдяки своїй неіонній природі вони, на відміну від іонних барвників, не викликають шкідливих темнових струмів і практично не агрегують.
• На основі квантово-хімічного аналізу, виявлені особливості бензо[cd]індолу, які обумовлюють короткі часи життя та низькі квантові виходи флуоресценції поліметинових барвників на його основі [100]. Знайдено, що залишок бензо[cd]індолу, на відміну від індолу чи бензімідазолу, дає значний вклад у граничні МО відповідних поліметинів, що обумовлює збільшення вібронних взаємодій у довгохвильових електронних переходах, а, відповідно, посилення внутрішньої конверсії.
• На основі квантово-хімічного аналізу електронної будови органічних молекул і процесів деградації світлової енергії в них спрогнозовано й синтезовано нові високоефективні радіолюмінофори, похідні піразоліну. Вони мають не тільки значні стоксові зсуви (80–100 нм), а й високі квантові виходи флуоресценції (75–98%). Синтезовані люмінофори мають високу яскравість флуоресценції під дією α-, β- та γ-опромінення в області чутливості фотоелектронних детекторів радіації. За величиною інтенсивності флуоресценції вони у 5 разів перевищують кращі з відомих аналогів. Це дозволило спільно з ученими Клемсонського університету (США) розробити й запатентувати полімерні сцинтилятори та дозиметри на їхній основі, здатні реагувати не тільки на величину дози, а й на тип радіоактивного випромінювання [101].
Публікації / посилання
1. А.И. Киприанов. Цвет и строение цианиновых красителей. – Киев: Наукова думка, 1979. – 666 с.
2. А.Д. Качковский. Строение и цвет полиметиновых красителей: Киев, Наукова думка, 1989. – 232 с.
3. А. А. Ищенко. Строение и спектрально-люминесцентные свойства полиметиновых красителей. – Киев: Наукова думка, 1994. – 232 с.
44. A.I. Tolmachev, Yu.L. Slominskii, A.A. Ishchenko. New cyanine dyes absorbing in the NIR region. In book: “New Infrared Dyes for High Technology Applications” NATO ASI Series 3. High Technology (Eds. S. Daehne, U. Resch-Genger and O.S. Wolfbeis). Dordrecht–Boston–London: Kluwer Academic Publishers. 1998. Vol. 52. P. 385–415. DOI:10.1007/978-94-011-5102-3_19
5. A.I. Tolmachev, A.Ya. Ilchenko. Polymethine dyes. In book: “Kirk-Othmer Encyclopedia of Chemical Technology”. Hoboken (US): John Wiley and Sons. – 2005. – Vol. 20. – P. 504–522.
6. А.Я. Ильченко. Основы теории цветности органических красителей. Киев: Наукова думка, 2012. – 264 c.
7. A.A. Ishchenko. Laser media based on polymethine dyes (reviews). – Quantum Electronics. – 1994. – Vol. 24, N 6. – P. 471–492. DOI:10.1070/QE1994v024n06ABEH000122
8. A.A. Ishchenko. Physicochemical aspects of the creation of modern light-sensitive materials based on polymethine dyes. – Theoretical and Experimental Chemistry. – 1998. – Vol. 34, N 4. – P. 191–210. DOI:10.1007/BF02523249
9. A.A. Ishchenko. Molecular Engineering of Dye-doped Polymers for Optoelectronics. – Polym. Adv. Technol. – 2002. – Vol. 13, N 10–12. – P. 744–752. DOI:10.1002/pat.269
10. Н.А. Давиденко, А.А. Ищенко, Н.Г. Кувшинский. Фотоника молекулярных полупроводниковых композитов на основе органических красителей. Киев: Наукова думка, 2005. – 296 c.
11. A. Ishchenko. Photo-converters based on dye-doped polymers. In book: “Specialty Polymers. Materials and Applications” (Ed. F. Mohammad), New Delhi–Bangalore–Mumbai: I.K. International. – 2007. – P. 301–356.
12. I.V. Kurdyukova, N.A. Derevyanko, A.A. Ishchenko, and D.D. Mysyk. Deeply coloured anionic polymethine dyes derived from bis(2,2,3,3,4,4,5,5-octafluoropentyl)-9H-fluorene-2,7-disulfonate. – Russian Chemical Bulletin. – 2009. – Vol. 58, N 4. – P. 828–837. DOI:10.1007/s11172-009-0102-7
13. I.V. Kurdyukova, N.A. Derevyanko, A.A. Ishchenko, and D.D. Mysyk. Symmetric anionic polymethine dyes derived from fluorene and its derivatives with electron-acceptor substituents: synthesis and spectral properties. – Russian Chemical Bulletin. – 2012. – Vol. 61, N 2. – P.287–297. DOI:10.1007/s11172-012-0040-7
14. A.A. Ishchenko, N.A. Derevyanko, S.V. Popov, Yu.L. Slominskil, V.L. Koval, S.A. Shapovalov, and N.O. Mchedlov-Petrosyan. Interaction of chromophores in dissimilar associates of cationic and anionic polymethine dyes in water. – Russian Chemical Bulletin. – 1997. – Vol. 46, N 5. – P. 910–915. DOI:10.1007/BF02496118
15. M.I. Demchuk, A. A. Ishchenko, Zh.A. Krasnaya, V.P. Mikhailov. The excited-state relaxation times of cationic-anionic polymethine dyes. – Chem. Phys. Lett. – 1990. – Vol. 167, N 1,2. – P. 170–174. DOI:10.1016/0009-2614(90)85090-Y
16. A. V. Kulinich and A.A. Ishchenko. Merocyanine dyes: synthesis, structure, properties, application (Review). – Russian Chemical Reviews. – 2009. – Vol. 78, N 2. – P. 141–164. DOI:10.1070/RC2009v078n02ABEH003900
17. I.V. Kurdyukova, A.A. Ishchenko, N.A. Derevyanko, and D.D. Mysyk. Synthesis and spectral properties of merocyanine dyes derived from tetranitrofluorene and heterocycles of various electron-donating ability. – Chemistry of Heterocyclic Compounds. – 2013. – Vol. 49, N 2. – P. 281–293. DOI:10.1007/s10593-013-1245-x
18. Ю.Л. Сломинский, И.Д. Радченко. Конденсация диметингемицианинов с кетонами. –Химия гетероцикл. соед. – 1974. – Т. 10, № 5. – С. 711–712.
19. Г.Г. Дядюша, А.А. Рыков, Ю.Л. Сломинский. Стереоизомерные превращения кетоцианинов. – Теор. эксперим. химия. – 1979. – Т. 15, № 1. – С. 76-81.
20. A.I. Tolmachev, N.N. Romanov, K.V. Fedotov, G.G. Dyadyusha, A.D. Kachkovski. A study of the vinylene shifts in polymethine dyes with sulphur-containing end-groups. – Dyes and Pigments. – 1988. – Vol. 9, N 6. – P. 443–451. DOI:10.1016/0143-7208(88)82003-5
21. A.I. Tolmachev and A.Ya. Ilchenko. Squarylium Dyes [in Russian]. – Russ. J. Sci. Appl. Photo. – 2001. – Vol. 42, N 6. – P. 483–509.
22. A.I. Tolmachev, V.V. Kurdyukov, Yu.G. Vlasenko, and A.N. Chernega. Synthesis, molecular, and crystal structure of 3,4-bis[(2,6-di-tert-butyl-4H-pyran-4-ylidene)methyl]cyclobut-3-ene-1,2-dione and -1,2-dithione. – Russian Journal of General Chemistry. – 2013. – Vol. 83, N 11. – P. 2088–2094. DOI:10.1134/S1070363213110224
23. V.V. Kurdyukov and A.I. Tolmachev. Synthesis and spectral-luminiscence properties of a symmetrical squaraine – a benzoxazolium derivative. – Chemistry of Heterocyclic Compounds. – 2009. – Vol. 45, N 10. – P. 1283–1284. DOI:10.1007/s10593-010-0422-4
24. I.V. Kurdiukova, A.V. Kulinich and A.A. Ishchenko. Near-infrared squarate and croconate dianions derived from tetranitrofluorene. – New J. Chem. – 2012. – Vol. 34, N 8. – P. 1564–1567. DOI:10.1039/C2NJ40303J
25. N.A. Davidenko, Yu.P. Getmanchuk, E.V. Mokrinskaya, L.N. Gumenyuk, V.A. Pavlov, N.G. Chuprina, N.N. Kuranda, S.V. Khutorny, A.A. Ishchenko, N.A. Derevenko, A.V. Kulinich, V.V. Kurdyukov, L.I. Kostenko. Croconium dye as a sensitizer of photothermoplastic holographic media for the near-IR region. – Journal of Optical Technology. – 2008. – Vol.75, N 3. – P. 182–186. DOI:10.1364/JOT.75.000182
26. K.V. Zyabrev, A.Ya. Ilchenko, Yu.L. Slominskii, N.N. Romanov, A.I. Tolmachev. Polymethine dyes derived from 2,2-difluoro-3,1,2(2H)oxaoxoniaboratines with polymethylene bridge groups in the chromophore. – Dyes Pigm. – 2006. – Vol. 71, N 3. – P. 199–206. DOI:10.1016/j.dyepig.2005.07.006
27. K. Zyabrev, A. Doroshenko, E. Mikitenko, Yu. Slominskii, A. Tolmachev. Design, synthesis, and spectral luminescent properties of a novel polycarbocyanine series based on the 2,2-difluoro-1,3,2-dioxaborine nucleus. – Eur. J. Org. Chem. – 2008. – N 9 – P. 1550–1558. DOI:10.1002/ejoc.200701012
28. Yu.V. Zatsikha, V.P. Yakubovskyi, M.P. Shandura, I.Ya. Dubey, Yu.P. Kovtun. An efficient method of chemical modification of BODIPY core. – Tetrahedron. – 2013. – Vol. 69. – P. 2233–2238. DOI:10.1016/j.tet.2013.01.050
29. M.P. Shandura, V.P. Yakubovskyi, Yu.P. Kovtun. 3,5-Bis(acetaldehyde) substituted BODIPY. – Org. Biomol. Chem. – 2013. – Vol. 11. – P. 835–841. DOI:10.1039/C2OB27004H
30. M.P. Shandura, V.P. Yakubovskyi, A.O. Gerasov, O.D. Kachkovskyi, Ye.M. Poronik, Yu.P.Kovtun. α-Polymethine-substituted boron dipyrromethenes – BODIPY-based NIR cyanine-like dyes. – Eur. J. Org. Chem. – 2012. – N 9. – P. 1825–1834. DOI:10.1002/ejoc.201101674
31. N.A. Derevyanko, A.A. Ishchenko, Yu.L. Slominski, A.I. Tolmachev. First examples of dyes of the pyridopyrylo- and pyridopolycarbocyanine series: Synthesis and special spectral-luminescent properties. – Mendeleev Communications. – 1991. – N3. – P. 91–92. DOI:10.1070/MC1991v001n03ABEH000055
32. M.P. Shandura, Ye.M. Poronik, Yu.P. Kovtun, A.A. Ishchenko. Substituted xanthylocyanines, Part IV: Trinuclear dyes with a pyronine nucleus. – Dyes and Pigments. – 2008. – Vol. 77, N 2. – P. 369–373. DOI:10.1016/j.dyepig.2007.06.007
33. L.A. Padilha, S. Webster, O.V. Przhonska, H. Honghua, D. Peceli, J.L. Rosch, M.V. Bondar, A.O. Gerasov, Yu.P. Kovtun, M.P. Shandura, A.D. Kachkovski, D.J. Hagan, E.W. Van Stryland. Nonlinear absorption in a series of Donor–π–Acceptor cyanines with different conjugation lengths. – J. Mater. Chem. – 2009. – Vol. 19, N 40. – P. 7503–7513. DOI:10.1039/B907344B
34. L.A. Padilha, S. Webster, O.V. Przhonska, H. Hu, D. Peceli, T. Ensley, M.V. Bondar, A.O. Gerasov, Yu.P. Kovtun, M.P. Shandura, A.D. Kachkovski, D.J. Hagan, E.W. Van Stryland. Efficient two-photon absorbing acceptor-π-acceptor polymethine dyes. – J. Phys. Chem. A –2010. – Vol. 114, N 23. – P. 6493–6501. DOI:10.1021/jp100963e
35. I.V. Kurdyukova, A.A. Ishchenko. Organic dyes based on fluorene and its derivatives. – Russian Chemical Reviews. – 2012. – Vol. 81, N 3. – P. 258–290. DOI:10.1070/RC2012v081n03ABEH004211
36. A.A. Ishchenko. Structure and spectral-luminescent properties of polymethine dyes. – Russian Chemical Reviews. – 1991. – Vol. 60, N 8. – P. 865–884. DOI:10.1070/RC1991v060n08ABEH001116
37. M.I. Demchuk, A.A. Ishchenko, V.P. Mikhailov, V.I. Avdeeva. The influence of the anion on the excited-state relaxation time of cationic polymethine dyes. – Chem. Phys. Lett. – 1988. – Vol. 144, N 1. – P. 99–103. DOI:10.1016/0009-2614(88)87097-0
38. A.A. Ishchenko, N.A. Derevyanko and A.M. Vinogradov. Photoinduced electron transfer in ion pairs of indotricarbocyanine dyes. – Russian Journal of General Chemistry. – 1997. – Vol. 67, N 7. – P. 1122–1125.
39. G.G. Dyadyusha and A.A. Ishchenko. Application of the method of moments to the study of the electronic spectra of organic dyes. – Journal of Applied Spectroscopy. – 1979. – Vol. 30, N 6. – P. 746–750. DOI:10.1007/BF00615763
40. A.A. Ishchenko. The nature of a heteroatom and spectral and luminescent properties of pyrylocyanine dyes. Optics and Spectroscopy. – 1994. – Vol. 77, N 5. – P. 771–776.
41. A.A. Ishchenko, N.A. Derevyanko and A.I. Tolmachev. The unusual effect of solvent on the shape of the absorption bands of nonsymmetrical pyrylocyanine dyes. – Doklady Akademii Nauk SSSR. – 1984. – Vol. 271, N 1. – P. 106–111.
42. A.A. Ishchenko, N.A. Derevyanko, V.M. Zubarovskii, A.I. Tolmachev. Influence of length of the polymethine chain on width of absorption bands of symmetric cyanine dyes. – Theoretical and Experimental Chemistry. – 1984. – Vol. 20, N 4. – P. 415–422. DOI:10.1007/BF00516576
43. A.A. Ishchenko, V.A. Svidro and N.A. Derevyanko. Solvatofluorochromy of cationic cyanine dyes. Dyes and Pigments. – 1989. – Vol. 10, N 2. – P. 85–96. DOI:10.1016/0143-7208(89)85001-6
44. A.A. Ishchenko. Photonics and molecular design of dye-doped polymers for modern light sensitive materials. – Pure and Appl. Chem. – 2008. – Vol. 80, N 7. – P. 1525–1538. DOI:10.1351/pac200880071525
45. R. Reisfeld, A. Weiss, T. Saraidarov, E. Yariv and A.A. Ishchenko. Solid-state lasers based on inorganic–organic hybrid materials obtained by combined sol–gel polymer technology. – Polym. Adv. Technol. – 2004. – Vol. 15, N 10–12. – P. 1–11. DOI:10.1002/pat.463
46. A.A. Ishchenko, I.L. Mushkalo, N.A. Derevyanko, U. Zakhidov, T.S. Khidirova, N.Nizamov. Association of bis-cyanine dyes with rigidly connected chromophores in solvents of various polarity. – J. Inf. Rec. Mater. – 1989. – Vol. 17, N 1. – P. 39–51.
47. A.A. Ishchenko, F.G. Kramarenko, A.G. Maydannic, S.V. Sereda, N.P. Vasilenko. Structure and association of carbocyanines of the benz[c,d]indole series in binary mixtures of solvents. – J. Inf. Rec. Mater. – 1991. – Vol. 19, N 3. – P. 207–219.
48. A.A. Ishchenko and S.A. Shapovalov. Heterogeneous association of the ions of dyes in solutions (Review). – Journal of Applied Spectroscopy. – 2004. – Vol. 71, N 5. – P. 605–629. DOI:10.1023/B:JAPS.0000049618.42857.0a
49. J. Wenus, S. Ceccarelli, D.G. Lidzey, A.I. Tolmachev, J.L. Slominskii, J.L. Bricks. Optical strong coupling in microcavities containing J-aggregates absorbing in near-infrared spectral range. – Organic Electronics. – 2007. – Vol. 8, N 2–3. – P. 120–126. DOI:10.1016/j.orgel.2006.06.006
50. А.Д. Некрасов, Б.И. Шапиро, А.И. Толмачев, Ю.Л. Сломинский, В.А. Кузьмин. Влияние органических полиэлектролитов на H*-агрегацию мезо-метилзамещенных тиакарбоцианиновых красителей. – Химия высоких энергий. – 2011. – Т. 45, № 6. – С. 563–569.
51. B.I. Shapiro, E.S. Kol’tsova, A.G. Vitukhnovskii, D.A. Chubich, A.I. Tolmachev, Yu.L. Slominskii, Interaction between gold nanoparticle plasmons and aggregates of polymethine dyes: “Invisible” nanoparticles. –Nanotech. Russia. – 2011. – Vol. 6, N 7–8. – P. 456–462. DOI:10.1134/S1995078011040112
52. B.I. Shapiro, L.S. Sokolova, V.A. Kuz’min, A.I. Tolmachev, Yu.L. Slominskii, and Yu.L. Briks. Effect of meso-alkyl substituents in the polymethine chain of thiacarbocyanines on the morphology of dye aggregates. – Nanotech. Russia. – 2012. – Vol. 7, N 5–6. – Р. 205–212. DOI:10.1134/S1995078012030159
53. A.A. Ishchenko, A.V. Kulinich, S.L. Bondarev, V.N. Knyukshto and A.A. Turban. Thermochromism and thermofluorochromism of merocyanines with a positive solvatochromism. – Optics and Spectroscopy. – 2006. – Vol. 101, N 1. – P. 90–97. DOI:10.1134/S0030400X06070162
54. A.V. Kulinich, N.A. Derevyanko and A.A. Ishchenko. Electronic structure and solvatochromism of merocyanines based on N,N-diethylthiobarbituric acid. – J. Photochemistry and Photobiology A. – 2007. – Vol. 188. – P.207–217. DOI:10.1016/j.jphotochem.2006.12.014
55. A. V. Kulinich, A A. Ishchenko and U. M. Groth. Electronic structure and solvatochromism of merocyanines. NMR spectroscopic point of view. – Spectrochimica Acta. Part A. – 2007. – Vol. 68, N 1. – P.6–14. DOI:10.1016/j.saa.2006.10.043
56. A.A. Ishchenko, A.V. Kulinich, S.L. Bondarev, and V.N. Knyukshto. Photodynamics of polyene-polymethine transformations and spectral fluorescent properties of merocyanine dyes. – J. Phys. Chem. A. – 2007. – Vol. 111, N 51. – P. 13629–13637. DOI:10.1021/jp076016u
57. A.V. Kulinich, N.A. Derevyanko, A.A. Ishchenko, S.l. Bondarev, V.N. Knyukshto. Structure and fluorescent properties of merocyanines based on N,N-diethylthiobarbituric acid. – J. Photochemistry and Photobiology A. – 2008. – Vol. 197, N 1. – P. 40–49. DOI:10.1016/j.jphotochem.2007.12.003
58. A.V. Kulinich, N.A. Derevyanko, and A.A. Ishchenko. Synthesis and spectral properties of cyanine dyes – derivatives of 10,10-dimethyl-7,8,9,10-tetrahydro-6H-pyrido[1,2-a]indolium. – J. Photochemistry and Photobiology A. – 2008. – Vol. 198, No 2–3. – P. 119–125. DOI:10.1016/j.jphotochem.2008.02.025
59. A.V. Kulinich, N.A. Derevyanko, A.A. Ishchenko, S.L. Bondarev, and V.N. Knyukshto. Structure and fluorescence properties of indole cyanine and merocyanine dyes with partially locked polymethyne chain. – J. Photochemistry and Photobiology A. – 2008. – Vol. 200, No 2–3. – P.106–113. DOI:10.1016/j.jphotochem.2008.06.020
60. A.I. Tolmachev,Yu.L. Slominsky, B.I. Shapiro. Carbocyanine with the ethylene and vinylene bridge groups in the chromophore. Synthesis, spectral and sensitizing properties. – Information Recording Materials. – 2003. – Vol. 4, N 3. – P. 3–8. link
61. V.A. Svetlichny, O.K. Bazyl, E.R. Kashapova, N.A. Derevyanko, and A.A. Ishchenko. Influence of absorption from excited singlet states on the lasing parameters of polymethine dyes. Quantum Electronics. – 2009. – Vol. 39, N 8. – P. 739–744. DOI:10.1070/QE2009v039n08ABEH013985
62. V.I. Bezrodnyi, A.A. Ishchenko. High efficiency lasing of the dye-doped polymer laser with 1.06 μm pumping. – Appl. Phys. B. – 2001. – Vol. 73, N 3. – P. 283–285. DOI:10.1007/s003400100646
63. N.A. Derevyanko, A.A. Ishchenko, I.G. Kuchma, A.A. Mak, A.G. Murzin, E.G. Pivinsky, D.S. Prilezhaev, Yu.L. Slominsky, Z.A. Smirnova, A.I. Tolmachev, V.A. Fromzel’, Fast-relaxation passive switch based on polymethine dyes for erbium laser with 1.54 μm wavelength. – Optics and Spectroscopy. – 1989. – Vol. 67, N 4. – P. 541–544.
64. V.I. Bezrodnyi, N.A. Derevyanko, A.A. Ishchenko. Highly efficient polymer passive switches for a ruby laser. – Quantum Electronics. – 1996. – Vol. 26, No 4. – P. 345-347. DOI:10.1070/QE1996v026n04ABEH000667
65. V.I. Bezrodnyi, A.A. Ishchenko, L.V. Karabanova, Yu.L. Slominskii. Highly stable polymethine-dye-based polymer switches for passive mode locking in neodymium laser. – Quantum Electronics. – 1995. – Vol. 25, No 8. – P. 819-822. DOI:10.1070/QE1995v025n08ABEH000477
66. R. Grigonis, M. Eidenas, V. Sirutkaitis, V. Bezrodnyi. A. Ishchenko, Yu. Slominskii. Relaxation times of new passive polymer switches for 1.06 μm. In book: “Ultrafast Processes in Spectroscopy”, Eds. O. Svelto, S. De Silvestri, G. Denardo. — Springer, Boston (MA). – 1996. – P. 449–453. DOI:10.1007/978-1-4615-5897-2_101
67. V.I. Bezrodnyi, A.A. Ishchenko. High-energy single pulse and multispike operation with a passive polymer Q-switch. – Optics and Laser Technology. – 2002. – Vol. 34, N 1. – P. 7–13. DOI:10.1016/S0030-3992(01)00080-9
68. V.I. Bezrodnyi, N.A. Derevyanko, A.A. Ishchenko, Yu.L. Slominskii. Polymer passive laser switches for stimulated emission in the region of 1.3 μm. – Quantum Electronics. – 1995. –Vol. 25, N 8. – P. 823–825. DOI:10.1070/QE1995v025n08ABEH000478
69. V.I. Bezrodnyi, N.A. Derevyanko, A.A. Ishchenko, L.V. Karabanova, T.A. Plisko, Yu.L. Slominskii, A.L. Smirnova. Absorption filters based on polymethine dyes for protection from laser radiation with a wavelength of 1060 nm. – J. Optical Technology. – 1996. – Vol. 63, N 12. – P. 936–940.
70. R.A. Ganeev, R.I. Tugushev, A.A. Ishchenko, N.A. Derevyanko, A.I. Ryasnyansky, T. Usmanov. Characterization of nonlinear optical parameters of polymethine dyes. – Appl. Phys. B. – 2003. – Vol. 76. – P. 683-686. DOI:10.1007/s00340-003-1146-2
71. S.L. Bondarev, S.A. Tikhomirov, V.N. Knyukshto, A.A. Turban, A.A. Ishchenko, A.V. Kulinich, I. Ledoux. – Fluorescence and solvatochromism of a merocyanine dye with a high quadratic polarizability in solutions and polymer films. – Journal of Luminescence. –2007. –Vol. 124, N 1. – P. 178–186. DOI:10.1016/j.jlumin.2006.07.001
72. V.A. Svetlichnyi, A.A. Ishchenko, E.A. Vaitulevich, N.A. Derevyanko, A.V. Kulinich. Nonlinear optical characteristics and lasing ability of merocyanine dyes having different solvatochromic behaviour. – Optics Communication. – 2008. – Vol. 281. – P. 6072–6079. DOI:10.1016/j.optcom.2008.09.067
73. A.V. Kulinich, N.A. Derevyanko, E.K. Mikitenko, A.A. Ishchenko. Merocyanines based on 1,3-indanedione: electronic structure and solvatochromism. – J. of Physical Organic Chemistry. – 2011. – Vol. 24, No 8. – P. 732 – 742. DOI:10.1002/poc.1821
74. N. Davidenko, I. Davidenko, A. Ishchenko, A. Kulinich, V. Pavlov, S. Studzinsky, N. Chuprina. Reversible holographic recording media based on polymeric composites and their use in energy-saving technologies. – Applied Optics. –2012. – Vol. 51, N 10. – P. C48–C54. DOI:10.1364/AO.51.000C48
75. Pat. No. 100823 (Ukraine). IPC G 03H 1/18. Optical medium for optical hologram recording / N.A. Davidenko, Yu.P. Hetmanchuk, O.V. Mokrynska, A.A. Ishchenko, N.A. Derevianko, S.Ya. Studzinskii, N.G. Chuprina, A.V. Kulinich // Industrial property [in Ukraine]. – 2013. – № 2.
76. Ya. Vertsimakha, A. Verbitsky, A. Ishchenko, N. Derevyanko. Photovoltaic properties of photosensitive in wide spectral region heterostructures. – In book “Moleular Low Dimensional and Nanostructured Materials for Advanced Applications” (Eds A. Graja et al.). – Amsterdam, Kluwer Academic Publishers. – 2002. – P. 311–314. DOI:10.1007/978-94-010-0349-0_38
77. Ya. Vertsimakha, A. Verbitsky, A. Ishchenko, V. Syromyatnikov, I. Pomaz. Effect of polymer molecular structure on photosensitivity of composites films based on infra-red polymethine dye. – Molecular Crystals and Liquid Crystals. – 2011. – Vol. 536. – P. 99(331)–106(338). DOI:10.1080/15421406.2011.538312
78. V.N. Bliznyuk, J. Gasiorowski, A.A. Ishchenko, G.V. Bulavko, N.A. Derevyanko, N.S. Sariciftci. Photoresistance and photo induced current hysteresis in bulk heterojunction systems P3HT–PCBM–polymethine dye. – Organic Electronics. – 2014. – Vol. 15, No 6. – P. 1105–1112. DOI:10.1016/j.orgel.2014.03.003
79. G.P. Grabchuk, A.Yu. Kolendo, N.A. Derevyanko, and A.A. Ishchenko. Effect of polymethine dyes with various electron-donating abilities of terminal groups on thermopolymerization of methylmethacrylate in solutions. – Molecular Crystals and Liquid Crystals. – 2008. – Vol. 497. – P. 76(408) – 83(415). DOI:10.1080/15421400802458548
80. US2010041045 (A1) Nucleic acid fluorescent stains/ A. Rueck, B. Schoenenberger, S. Yarmoluk, V. Kovalska, M. Losytskyy, Y. Slominskii ― Pub.date 2010-02-18. link
81. M. Baume, J. Bricks, R. Meier, A. Ruck, B. Schonenberger, J. Slominskii, A. Tolmachev, K. Trummler. New red emitting fluorescence dyes for protein labelling. – 8th Siena Meeting 2008 “From Genome to Proteome: Integration and Proteome completion”. – Siena, Italy, 2008, August 31st – September 4th.
82. A.S. Tatikolov, I.G. Panova, A.A. Ishchenko, and M.A. Kudinova. Spectral and fluorescent study of the interaction of squarylium dyes, derivatives of 3H-indolium, with albumins. –Biophysics. – 2010. – Vol. 55, N 1. – P. 35–40. DOI:10.1134/S0006350910010070
83. D. Peceli, H. Hu, D.A. Fishman, S.Webster, O.V. Przhonska, V.V. Kurdyukov, Y.L. Slominsky, A.I. Tolmachev, A.D. Kachkovski, A.O. Gerasov, A.E. Masunov, D.J. Hagan, E.W. Van Stryland, Enhanced intersystem crossing rate in polymethine-like molecules: sulfur-containing squaraines versus oxygen-containing analogues. – J. Phys. Chem. A. – 2013. – Vol. 117. – P. 2333−2346. DOI:10.1021/jp400276g
84. J.L. Bricks, G. Reck, K. Rurack, B. Schulz, M. Spieles. Cation coordination of bisamidopyridine-derived receptors as investigated in the solid-state and in solution. – Supramolecular Chemistry. – 2003. – Vol. 15. – P. 189–197. DOI:10.1080/1061027031000078239
85. A. Kovalchuk, J.L. Bricks, G. Reck, K. Rurack, B. Schulz, A. Szumna, H. Weißhoff. A charge transfer-type fluorescent molecular sensor that “lights up” in the visible upon hydrogen bond-assisted complexation of anions. – Chem. Commun. – 2004. – P. 1946–1947. DOI:10.1039/B405207B
86. M.P. Shandura, Yu.P. Kovtun, V.P. Yakubovskyi, Yu.P. Piryatinski, P.M. Lutsyk, R.J. Perminov, A.B. Verbitsky, A. Rozhin. Dehydroacetic acid based dioxaborine styryl dye: effective fluorescent probe for ammonia and amine detection. – Key Engineering Materials. –2014. – Vol. 605. – P. 159–162. DOI:10.4028/www.scientific.net/KEM.605.159
87. A.A. Ishchenko, A.V. Kulinich, S.V. Shishkina. Effect of donor terminal group and polymethine chain length on structure of merocyanine dyes in the crystal state. – Dyes Pigm. – 2017. – Vol. 145. – P. 181–188. DOI:10.1016/j.dyepig.2017.06.009
88. S. Shishkina, V. Dyakonenko, A. Ishchenko, A. Kulinich. Ideal polymethine state of merocyanines in the crystal. – Struct. Chem. – 2021. DOI:10.1007/s11224-021-01834-7
89. N. Ibrayev, E. Seliverstova, A. Ishchenko, M. Kudinova. The effect of sulfonate groups on spectral-luminescent and photovoltaic properties of squarylium dyes. – J. Photochem. Photobiol. A. – 2017. – Vol. 346. – P. 570–575. DOI:10.1016/j.jphotochem.2017.06.029
90. V. Polishchuk, M. Stanko, A. Kulinich, M. Shandura. D–π–A–π–D dyes with a 1,3,2-dioxaborine cycle in the polymethine chain: Efficient long-wavelength fluorophores. – Eur. J. Org. Chem. – 2018. – Vol. 2018, N 2. – P. 240–246. DOI:10.1002/ejoc.201701466
91. V. Polishchuk, A. Kulinich, E. Rusanov, M. Shandura. Highly fluorescent dianionic polymethines with a 1,3,2-dioxaborine core. – J. Org. Chem. – 2021. – Vol. 86, N 7. – P. 5227–5233. DOI:10.1021/acs.joc.1c00138
92. A.A. Ishchenko, A.V. Kulinich, S.L. Bondarev, T.F. Raichenok. UV–Vis absorption spectra and electronic structure of merocyanines in the gas phase. – Spectrochim. Acta A. – 2018. – Vol. 190. – P. 332–335. DOI:10.1016/j.saa.2017.09.054
93. A.V. Kulinich, A.A. Ishchenko, I.N. Kukhta, L.K. Mitryukhin, S.M. Kazakov, A.V. Kukhta. Electron impact excitation of the merocyanine molecule in the gas phase. – Chem. Phys. – 2018. – Vol. 503. – P. 20–24. DOI:10.1016/j.chemphys.2018.01.019
94. A.V. Kulinich, A.A. Ishchenko, S.L. Bondarev, V.N. Knyukshto. Low-temperature effect on the electronic structure and spectral-fluorescent properties of highly dipolar merocyanines. – J. Phys. Chem. A. – 2018. – Vol. 122, N 50. – P. 9645–9652. DOI:10.1021/acs.jpca.8b09522
95. A.V. Kulinich, A.A. Ishchenko, S.L. Bondarev, V.N. Knyukshto. Effect of donor and acceptor end-groups on electronic structure and spectral-fluorescent properties of merocyanines in frozen ethanol. – J. Photochem. Photobiol. A. – 2021. – Vol. 405. – Paper no. 112932. DOI:10.1016/j.jphotochem.2020.112932
96. A.V. Kulinich, V.V. Kurdyukov, A.A. Ishchenko. Effect of bulky substituents in the donor and acceptor terminal groups on solvatochromism of Brooker’s merocyanine. – New J. Chem. – 2019. – Vol. 43, N 19. – P. 7379–7385. DOI:10.1039/c9nj00831d
97. H.V. Humeniuk, N.A. Derevyanko, A.A. Ishchenko, A.V. Kulinich. Merocyanines based on 1,2-diphenyl-3,5-pyrazolidinedione. – New J. Chem. – 2019 – Vol. 43, N 35. – P. 13954–13966. DOI:10.1039/c9nj03275d
98. A.V. Kulinich, N.A. Derevyanko, A.A. Ishchenko, et al. Structure and redox properties of polymethine dyes: Electrochemical and DFT/TD-DFT study. – Dyes Pigm. – 2019 – Vol. 161. – P. 24–33. DOI:10.1016/j.dyepig.2018.09.031
99. N.A. Derevyanko, A.A. Ishchenko, A.V. Kulinich. Deeply coloured and highly fluorescent dipolar merocyanines based on tricyanofuran. – Phys. Chem. Chem. Phys. – 2020 – Vol. 22, N 5. – P. 2748–2762. DOI:10.1039/c9cp05827c
100. A.V. Kulinich, A.A. Ishchenko. Structural background of fast nonradiative deexcitation of benzo[cd]indole polymethine dyes. Comput. Theor. Chem. 2020 – Vol. 1178. – Paper no. 112782. DOI:10.1016/j.comptc.2020.112782
101. V.N. Bliznyuk, A.F. Seliman, T.A. DeVol, N.A. Derevyanko, A.A. Ishchenko. Organic Scintillators Derived from Pyrazoline. – U.S. Patent No. US 10,800,966 B2, Oct. 13, 2020. link

Напишіть відгук
Пробачте, щоб відправити коментар, маєте увійти в систему.